

-
公司介绍
-
产品中心
- Eppendorf
- 致微
- Haier
- Yokogawa
- ESCO
- Gator
- Merck
- 汇芯生物
- Namocell
- QIAGEN
- BECKMAN
- Agilent
- 中博瑞康
- Readily 3D
- FIDA
- PS
- GPT
- Protein Biosolutions
- RadSource
- EXCILONE
- HALO
-
资源中心
-
应用中心
-
服务支持
- 联系我们
-
诚聘英才


-
公司介绍
-
产品中心
- Eppendorf
- 致微
- Haier
- Yokogawa
- ESCO
- Gator
- Merck
- 汇芯生物
- Namocell
- QIAGEN
- BECKMAN
- Agilent
- 中博瑞康
- Readily 3D
- FIDA
- PS
- GPT
- Protein Biosolutions
- RadSource
- EXCILONE
- HALO
-
资源中心
-
应用中心
-
服务支持
- 联系我们
-
诚聘英才
Science 重磅 | Gator® 助力基因疗法突破血脑屏障,为脑部疾病治疗带来新希望!
来源:Gator Bio

最近,金融题材电视剧《城中之城》热播。
剧中男主角赵辉的女儿蕊蕊,患原发性视网膜色素变性,会导致进行性视野丧失及视力下降。
他联系了国外的医院,选择 AAV 基因疗法,但是治疗费高达一千五百万!
身为行长的赵辉,为了给女儿治病不惜铤而走险 ……
欣慰的是,经过治疗后,蕊蕊恢复了视力。

基因疗法这么强大,是不是也可以治疗常见的脑部疑难疾病呢,例如帕金森病、阿尔茨海默病等?
几十年来,载体通过血脑屏障一直是阻碍脑部疾病基因疗法的难题之一。虽然基因疗法有可能治疗一系列严重的遗传性脑部疾病,但是,FDA 批准的最常用的用于包装和运送这些治疗药物到靶细胞的载体:腺相关病毒 ( AAV ),不能有效地高水平穿过血脑屏障并运送治疗货物。
近日,Science 刊登来自麻省理工学院和哈佛大学布罗德研究所 Benjamin E Deverman 团队的研究成果,题为:An AAV capsid reprogrammed to bind human transferrin receptor mediates brain-wide gene delivery[1] 。研究团队通过改造 AAV 递送载体,与人转铁蛋白受体 ( TfR1,在人体血脑屏障中高表达 ) 结合,精准穿透血脑屏障,介导有效的中枢神经系统范围内的基因传递,为人类脑病治疗带来变革。该突破性的研究使用 Gator® 完成了大量关键性的实验,让我们来一探究竟吧!
Part 1
如何完成与 hTfR1 结合的 AAV 病毒衣壳筛选?
该筛选部分体外实验主要依靠 Gator® BLI 完成 :包括亲和力筛选、结合位点确认再到阻断实验验证,显著加快了筛选效率和研究进展!
通过改造 AAV9 衣壳 (随机在 VP1 588–589 残基序列中,插入7-Mer-AAV9,图1),筛选了 4 种衣壳蛋白,利用 Gator® 分别检测 BI-hTFR1, BI-hTFR1-2,BI-hTFR1-3,BI-hTFR1-4 与 TfR1 的结合(图2)。Gator® BLI 结果显示并未检测到 AAV9 与 TfR1 的结合,而每种 BI-hTFR1 衣壳都显示出与 TFR1 有浓度依赖性结合。并且细胞实验证明,对比 AAV9,这四种重组衣壳 AAV 在脑内皮细胞系中转导效率更高。综合结合能力以及细胞转导效率,团队选择 BI-hTFR1 进行后续的实验。
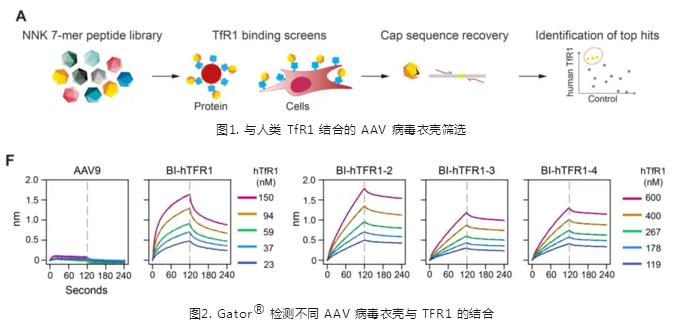
Gator® BLI 检测 AAV 和 TfR1 动力学过程:AAVX 光纤传感器分别固化 BI-hTFR1,BI-hTFR1-2,BI-hTFR1-3,BI-hTFR1-4 和 AAV9,结合 TfR1。
为了判断 BI-hTFR1 增加脑内皮细胞转导是否和 TfR1 有关以及 BI-hTFR1 与 TfR1 的结合位点,研究团队使用 2 种 Anti-TfR1 的抗体(OKT9:单抗、结合 TfR1 顶端结构域,AF2474:多抗,与 Transferrin 竞争性结合)进行阻断实验,发现增加 OKT9 的浓度(而不是 AF2474的浓度)能抑制细胞转导,并且 Gator® BLI 结果表明 OKT9 直接与 BI-hTFR1 竞争结合纯化的人TfR1(图3)。因此也证明 BI-hTFR1结合 TfR1顶端结构域从而介导细胞转导。

Gator® BLI 完成多元竞争关系检测:
二元竞争检测:HFCII 光纤传感器固化 Fc-hTfR1,结合BI-hTFR1,再结合 OKT9 ; 看在有 BI-hTfR1 结合下 OKT9 是否还有结合信号,若有则代表两者不是竞争,若信号极弱或没有,则代表两者是竞争关系。
三元竞争检测:SA 光纤传感器固化 biotin-TF 或未固化,结合 rh TfR1 后与 OKT9 结合,再与 BI-hTFR1 结合。比较不同条件下,是否阻断 TfR1 与 BI-hTFR1 的结合。
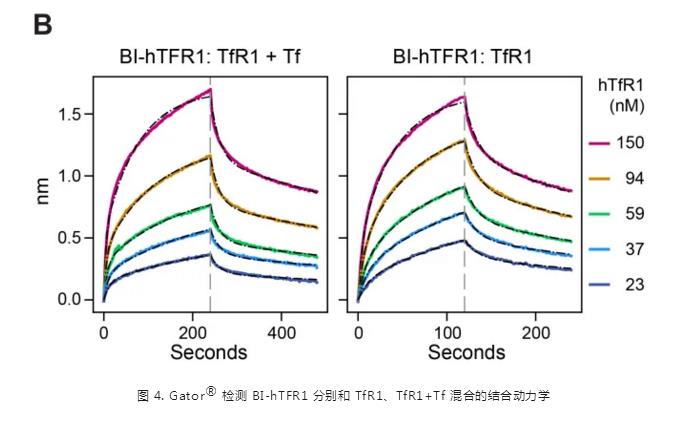
同时利用 Gator® 完成动力学实验显示,不管是否在 TfR1 中加入 holo-Tf,都不影响 TfR1 与 BI-hTFR1 之间的结合能力,并且 BI-hTFR1 可以结合预先形成的 TfR1 和 Tf 复合物(图4)。
Part 2
那么 BI-hTFR1递送基因治疗药物的效果如何?
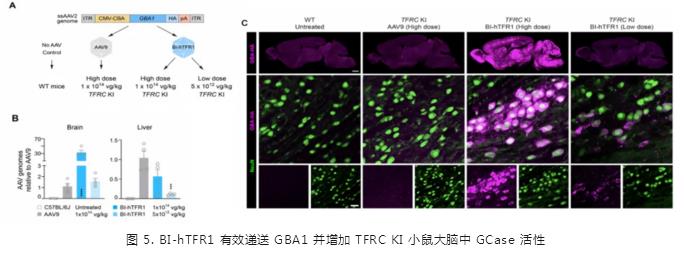
研究人员将 BI-hTFR1 注射到表达人源化转铁蛋白受体的小鼠血液中,发现与没有人类转铁蛋白受体的小鼠相比,前者大脑和脊髓中的 AAV 水平显著升高;而与 AAV9 相比,BI-hTFR1 在中枢神经系统中的表达高出了 40-50 倍,并且抵达了大脑不同区域 71% 的神经元和 92% 的星形胶质细胞。这些数据都证实了 BI-hTFR1 穿越血脑屏障的强大能力。
接下来,研究团队测试了 BI-hTFR1 递送特定基因的效率。在人体中,GBA1(葡萄糖脑苷脂酶1)基因突变已被证实可以导致一种罕见的溶酶体贮积病——戈谢病,并且还与帕金森病相关。研究团队使用 BI-hTFR1 向 TFRC-KI 小鼠递送人类 GBA1 基因的健康拷贝,发现其递送的 GBA1 基因拷贝量是 AAV9 的约 30 倍,并且在小鼠大脑以及脑脊液中,葡萄糖脑苷脂酶的活性都得到了显著提升,说明 BI-hTFR1 将目标基因成功递送至整个大脑的大部分细胞中。
研究亮点:
1. 利用 Gator® BLI 快速筛选出与 hTfR1 结合的 BI-hTFR1,并确定BI-hTFR1结合 TfR1顶端结构域从而介导细胞转导,实现 AAV 载体穿过血脑屏障;
2. 与 AAV9 相比,BI-hTFR1 在中枢神经系统中的表达高出了40-50 倍,可作为未来靶向中枢神经系统基因疗法的极有前途的载体之一。
小 结
在 AAV 基因治疗研究中,Gator® 可以在各个阶段大展身手:
从早期的 AAV 载体改造筛选(AAV 载体与靶蛋白亲和力、结合位点确认),到中期大规模生产(AAV 衣壳滴度定量、AAV 空壳率检测、AAV 基因滴度检测),以及后期的临床药效检测(AAV 治疗后体液免疫产生的抗体与 AAV 的动力学),Gator® 都能提供相应的解决方案。
通过这些应用,Gator® 助力科学家们在基因治疗领域实现了新的突破,为神经系统相关疾病的治疗带来了新希望!
行业资讯
NEWS

