

-
公司介绍
-
产品中心
- Eppendorf
- 致微
- Haier
- Yokogawa
- ESCO
- Gator
- Merck
- 汇芯生物
- Namocell
- QIAGEN
- BECKMAN
- Agilent
- 中博瑞康
- Readily 3D
- FIDA
- PS
- GPT
- Protein Biosolutions
- RadSource
- EXCILONE
- HALO
-
资源中心
-
应用中心
-
服务支持
- 联系我们
-
诚聘英才


-
公司介绍
-
产品中心
- Eppendorf
- 致微
- Haier
- Yokogawa
- ESCO
- Gator
- Merck
- 汇芯生物
- Namocell
- QIAGEN
- BECKMAN
- Agilent
- 中博瑞康
- Readily 3D
- FIDA
- PS
- GPT
- Protein Biosolutions
- RadSource
- EXCILONE
- HALO
-
资源中心
-
应用中心
-
服务支持
- 联系我们
-
诚聘英才
HALO助力复旦、中科院、浙大Science重磅研究:人类癌症中肿瘤浸润性B细胞的蓝图
来源:Indica labs
目前的肿瘤免疫治疗主要致力于重建T细胞和NK细胞的功能,但仅对一小部分患者有效,因此亟需发展新的免疫治疗策略。B细胞作为抗体应答的效应细胞,通过生发中心(Germinal center, GC)或滤泡外(Extrafollicular, EF)途径分化为浆细胞。B细胞也是肿瘤浸润淋巴细胞的重要组成部分,但其发挥抗肿瘤或促肿瘤作用仍存在争议。近年来,在泛癌尺度下对肿瘤微环境(Tumor microenvironment, TME)中的免疫细胞进行相关研究,为系统性地探究B细胞异质性及其功能提供了新的视角。
5月3日,中国科学院上海免疫与感染研究所张晓明研究员与复旦大学附属中山医院高强教授、樊嘉院士及浙江大学郭国骥教授合作在Science上发表了题为“A blueprint for tumor-infiltrating B cells across human cancers”的研究论文,揭示了肿瘤浸润B细胞的两种应答模式及其对抗肿瘤免疫的影响,为发展新型免疫治疗策略提供了重要基础。

研究中共汇编了20种人类癌症的TIB(Tumor-infiltrating B cells)图谱,系统性地表征了15个B细胞亚群,并发现了此前未知的AtM B细胞和TME中的EF途径。数据揭示了两种不同的ASC分化途径:GC和EF途径,并表现出癌症类型偏好。与传统GC B细胞相比,研究者描述了AtM B细胞的独特表型、功能、TLS定位和临床意义。特别是,作为EF衍生ASCs的祖细胞,肿瘤浸润性AtM B细胞表现出耗竭和旁观者表型,并独立于GC发育。研究者将这些发现与特定的转录因子和表观遗传调控联系起来,证明了代谢微环境的影响,其中谷氨酰胺在调节AtM B细胞分化和免疫调节功能中发挥作用。这项研究提供了大规模B细胞转录组数据,为研究TIBs提供了宝贵资源,并有望为B细胞靶向癌症免疫疗法提供指导。
| HALO在该研究中的评估方法及研究结果 |
在研究肿瘤浸润性B细胞(TIBs)在滤泡外B细胞和未成熟的三级淋巴结构(TLSs)的空间位置分布关系时,研究者利用HALO数字病理图像分析平台对多色免疫组化染色切片进行分析,以识别肿瘤浸润的浆细胞(ASCs)、异常记忆B细胞(AtM B细胞)和不同TLS结构。通过HALO空间分析中的浸润分析功能,研究者分析了AtM B细胞在成熟和不成熟TLSs中的空间定位(图1)。结果显示,AtM B细胞高度表达TLS特征,这表明它们可能位于TLS中。
在进一步的分析中,研究者将肿瘤组织分为TLS和非TLS区域,并观察到AtM B细胞与TLS之间存在显著相关性,这提示AtM B细胞可能在TLS形成中发挥作用。此外,研究者筛选了来自LIHC(n=17)和COAD(n=6)的不同TLS阶段的整个组织切片,并按照T细胞、B细胞数量和fDC染色将TLS分为四个阶段。结果表明,AtM B细胞在未成熟TLS中显著富集,而Bm主要位于COAD和LIHC的成熟TLS中。不同TLS阶段的ASC密度无差异。
正如预期的那样,AtM B细胞主要富集于外滤泡优势癌症,如GIST、CESC、LIHC和HNSC,而生发中心B细胞则高度丰富于生发中心优势癌症,如COAD、THCA和LC。这表明生发中心优势癌症主要含有成熟TLS,而外滤泡优势癌症则含有未成熟TLS。在OV等同时存在外滤泡和生发中心途径的癌症中,AtM和生发中心亮区B细胞的浸润程度与其他癌症相比较为中等。
在空间上位置上计算AtM B细胞在TLS或滤泡内外边缘200微米范围内的密度,以及AtM B细胞到界面的距离。结果发现AtM B细胞主要位于未成熟TLS的中心,这与早期外滤泡反应和促进TLS形成一致(图1D和E)。随着TLS成熟,AtM B细胞迁移到外围,而幼稚B细胞则持续位于TLS中心。这些数据验证了AtM B细胞的生发中心独立发育,并且还表明TLS成熟阶段驱动外滤泡和生发中心优势癌症中不同的B细胞分化。
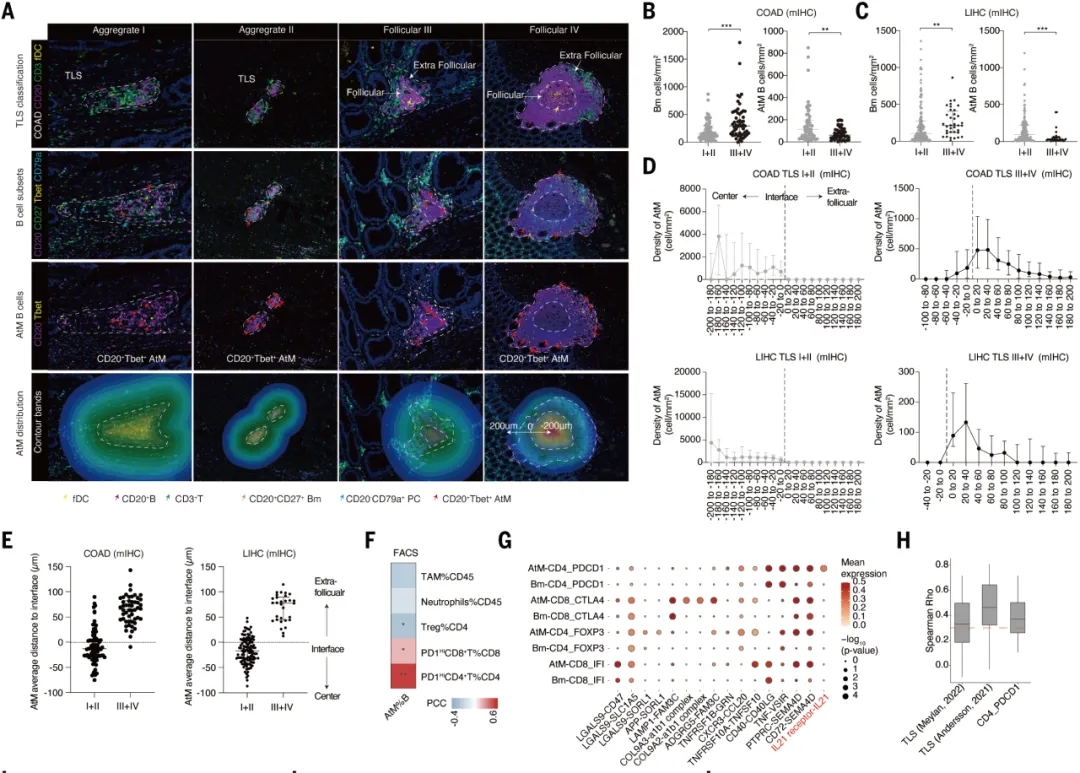
图1 基于HALO研究肿瘤浸润性B细胞(TIBs)在滤泡外B细胞和未成熟的三级淋巴结构(TLSs)的空间位置分布关系
本研究编制了人类癌症中B细胞异质性和两种动态分化途径的蓝图,为未来的研究提供了ASC分化轨迹的基本参考。EF和GC途径之间的系统比较揭示了不同癌症类型B细胞状态的相似性和差异性,突出了与EF途径相关的AtM B细胞的免疫抑制微环境相关的不利临床结果。代谢表观遗传网络非常灵活,可以重新配置B细胞的命运,从而促进B细胞靶向免疫疗法的发展。
参考文献:
Ma J, Wu Y, Ma L, et al. A blueprint for tumor-infiltrating B cells across human cancers[J]. Science, 2024, 384(6695): eadj4857.
行业资讯
NEWS

